Efficacia del trattamento con nirmatrelvir-ritonavir o molnupiravir tra i veterani statunitensi
6 giugno 2023. Ann Intern Med. Effectiveness of COVID-19 Treatment With Nirmatrelvir-Ritonavir or Molnupiravir Among U.S. Veterans: Target Trial Emulation Studies With One-Month and Six-Month OutcomesL'obiettivo dello studio è esaminare l'incidenza di qualsiasi ricovero o mortalità per tutte le cause a 30 giorni e da 31 a 180 giorni.
Nirmatrelvir-ritonavir si è dimostrato efficace nel ridurre l'ospedalizzazione a 30 giorni e la mortalità; Molnupiravir è stato associato a un beneficio per la mortalità a 30 giorni ma non per l'ospedalizzazione. Con entrambi gli antivirali sono state osservate ulteriori riduzioni di mortalità nel follow up da 31 a 180 giorni.
25 maggio 2023.
FDA approva il primo antivirale orale per il trattamento di COVID-19 negli adultiPaxlovid ha soddisfatto i rigorosi standard di sicurezza ed efficacia e rimane un'importante opzione terapeutica per le persone ad alto rischio di progressione verso COVID-19 grave, comprese quelle con precedente immunità. Leggi il
comunicato stampa dell'FDANirmatrelvir-ritonavir rispetto a altri farmaci antivirali
30 aprile 2023. J Med Virol. Nirmatrelvir-ritonavir compared with other antiviral drugs for the treatment of COVID-19 patients: A systematic review and meta-analysis.
L'obiettivo dello studio è valutare l'efficacia e la sicurezza di nirmatrelvir-ritonavir rispetto ad altri farmaci antivirali e l'impatto di diversi farmaci antivirali sugli effetti a breve e lungo termine di COVID-19. Nirmatrelvir-ritonavir può ridurre la mortalità e l'ospedalizzazione dei pazienti con COVID-19 rispetto ad altri farmaci antivirali. Rimane la necessità di ulteriori studi su larga scala per convalidare questi risultati.
Efficacia, tollerabilità di Molnupiravir, Remdesivir e Nirmatrelvir/ritonavir: dati del mondo reale nei primi dieci mesi di utilizzo
28 aprile 2023. Viruses. Effectiveness, Tolerability and Prescribing Choice of Antiviral Molecules Molnupiravir, Remdesivir and Nirmatrelvir/r: A Real-World Comparison in the First Ten Months of UseNel 2022 sono stati introdotti tre farmaci antivirali, molnupiravir, remdesivir e nirmatrelvir/ritonavir, per il trattamento di COVID-19 da lieve a moderato nei pazienti ad alto rischio, in cui la vaccinazione potrebbe non essere sufficiente per la prevenzione della malattia grave. Lo scopo dello studio è valutare la loro efficacia e tollerabilità in un contesto di vita reale. È stato avviato uno studio osservazionale monocentrico, con il coinvolgimento di 1118 pazienti, con dati di follow-up completi, trattati tra il 5 gennaio e il 3 ottobre 2022 presso un ospedale di Latina, Centro Italia. Un'analisi univariata e un'analisi multivariata sono state eseguite rispettivamente sui dati clinici e demografici e sull'esito composito, la persistenza dei sintomi a 30 giorni e il tempo alla negativizzazione. I tre antivirali hanno mostrato un'efficacia simile nel contenere la progressione dell'infezione a COVID-19 grave e una buona tollerabilità in assenza di gravi effetti avversi. La persistenza dei sintomi dopo 30 giorni era più comune nelle donne rispetto ai maschi e meno comune nei pazienti trattati con molnupiravir e nirmatrelvir/ritonavir. La disponibilità di diverse molecole antivirali è uno strumento forte e, se correttamente prescritte, possono avere un ruolo significativo nel modificare la storia naturale dell'infezione per le persone fragili, in cui la vaccinazione potrebbe non essere sufficiente per la prevenzione del COVID-19 grave.
Nirmatrelvir e sintomi persistenti post Covid-19
23 marzo 2023. JAMA Intern Med. Association of Treatment With Nirmatrelvir and the Risk of Post-COVID-19 ConditionLo studio ha coinvolto un totale di 281.793 pazienti (età media [DS], 61,99 [14,96]; 242.383 [86,01%] maschi) che avevano un risultato positivo al test SARS-CoV-2 e almeno 1 fattore di rischio per la progressione a COVID-19 severa. Tra questi, 246.076 non hanno ricevuto alcun trattamento antivirale o anticorpale durante la fase acuta dell'infezione da SARS-CoV-2 e 35.717 hanno ricevuto nirmatrelvir oralmente entro 5 giorni dal risultato positivo del test SARS-CoV-2. Questo studio di coorte ha rilevato che nelle persone con infezione da SARS-CoV-2 che presentavano almeno 1 fattore di rischio per la progressione a malattia grave, il trattamento con nirmatrelvir entro 5 giorni da un risultato positivo del test SARS-CoV-2 era associato a un ridotto rischio di condizione post-COVID-19 (PCC) e indipendentemente dallo stato di vaccinazione e dalla storia di infezione precedente; la totalità dei risultati suggerisce che il trattamento con nirmatrelvir durante la fase acuta di COVID-19 può ridurre il rischio di esiti post-acuti avversi per la salute.
Nirmatrelvir-ritonavir nella prevenzione di ricoveri e decessi: studio di coorte USA
15 marzo 2023. Lancet Infect Dis. Effectiveness of nirmatrelvir-ritonavir in preventing hospital admissions and deaths in people with COVID-19: a cohort study in a large US health-care systemNello studio sono stati inclusi 7274 destinatari di nirmatrelvir-ritonavir e 12.152 non destinatari con test SARS-CoV-2 positivi. 5472 (75,2%) destinatari del trattamento e 84.657 (67,1%) non riceventi sono stati testati entro 5 giorni dall'insorgenza dei sintomi. Nirmatrelvir-ritonavir ha avuto un'efficacia complessiva stimata del 53,6% (IC 95% 6,6-77,0) nel prevenire il ricovero ospedaliero o il decesso entro 30 giorni da un test positivo per SARS-CoV-2, che è aumentato a 79,6% (33·9-93·8) quando nirmatrelvir-ritonavir è stato somministrato entro 5 giorni dall'insorgenza dei sintomi.
Farmaci antivirali e anticorpi monoclonali: studio di coorte su 23,4 milioni di persone
13 marzo 2023. BMJ Med. Trends, variation, and clinical characteristics of recipients of antiviral drugs and neutralising monoclonal antibodies for covid-19 in community settings: retrospective, descriptive cohort study of 23.4 million people in OpenSAFELY.
Lo studio si basa sui dati clinici di 23,4 milioni di persone collegati ai dati sull'infezione e il trattamento di Covid-19, all'interno del database OpenSAFELY-TPP.
Nirmatrelvir/ritonavir (paxlovid), sotrovimab, molnupiravir, casirivimab/imdevimab o remdesivir sonoi farmaci indagati.
Utilizzando la piattaforma OpenSAFELY, gli autori sono stati in grado di identificare i pazienti con Covid-19 ad alto rischio di esiti gravi potenzialmente idonei a ricevere il trattamento e valutare la copertura di questi nuovi trattamenti tra questi pazienti. Potrebbe essere necessaria un'attività mirata per risolvere l'apparente minore copertura terapeutica osservata tra alcuni gruppi, in particolare (al momento): differenze tra regioni dell'NHS, gruppi etnici, persone di età ≥80 anni, coloro che vivono in aree socioeconomicamente svantaggiate e nei residenti delle case di cura.
Nirmatrelvir-ritonavir in pazienti ambulatoriali con COVID-19 durante Omicron tra cui BA.4 e BA.510 febbraio 2023. Lancet Infect Dis. Real-world use of nirmatrelvir-ritonavir in outpatients with COVID-19 during the era of omicron variants including BA.4 and BA.5 in Colorado, USA: a retrospective cohort studyTra 28.167 pazienti infettati da SARS-CoV-2 tra il 26 marzo e il 25 agosto 2022, 21.493 hanno soddisfatto i criteri di inclusione dello studio. 9881 pazienti hanno ricevuto il trattamento con nirmatrelvir-ritonavir e 11.612 non sono stati trattati. Il trattamento con nirmatrelvir-ritonavir è stato associato a una riduzione dell'ospedalizzazione per tutte le cause di 28 giorni rispetto a nessun trattamento antivirale (61 [0·9%] di 7168 pazienti vs 135 [1·4%] di 9361 pazienti, odds ratio (OR) aggiustato 0 ·45 [IC 95% 0·33-0·62]; p<0·0001). Il trattamento con nirmatrelvir-ritonavir è stato anche associato a una riduzione della mortalità per tutte le cause a 28 giorni (due [<0·1%] su 7168 pazienti vs 15 [0·2%] su 9361 pazienti; OR aggiustato 0·15 [95% CI 0 ·03-0·50]; p=0·0010). Utilizzando le successive visite al pronto soccorso come surrogato di recidive clinicamente significative, abbiamo osservato una diminuzione dopo il trattamento con nirmatrelvir-ritonavir (283 [3·9%] di 7168 pazienti vs 437 [4·7%] di 9361 pazienti; OR aggiustato 0·74 [IC 95% 0·63-0·87]; p=0·0002).
Paxlovid associato a diminuzione del tasso di ospedalizzazione
23 gennaio 2023. Am J Transplant.
Paxlovid associated with decreased hospitalization rate among adults with COVID-19 - United States, April-September 2022.Tra gli adulti statunitensi con diagnosi di COVID-19, compresi quelli con precedente infezione o vaccinazione, le persone a cui è stato prescritto Paxlovid entro 5 giorni dalla diagnosi hanno avuto un tasso di ospedalizzazione inferiore del 51% entro 30 giorni dalla diagnosi, rispetto a coloro a cui il farmaco non è stato prescritto.
13 gennaio 2023. OMS. Nirmatrelvir-ritonavir for COVID-19 e
Administration of Nirmatrelvir-ritonavir for COVID-19
Guida per gli operatori sanitari (clicca sull'immagine per aprire il pdf)
Paxlovid (Nirmatrelvir e Ritonavir) nelle donne in gravidanza e in allattamento: prove attuali e linee guida pratiche10 gennaio 2023. Vaccines (Basel). Paxlovid (Nirmatrelvir and Ritonavir) Use in Pregnant and Lactating Woman: Current Evidence and Practice Guidelines - A Scoping Review.
Questo articolo riassume i dati disponibili sull'uso di ritonavir e nirmatrelvir in gravidanza negli studi clinici in corso. Sono esaminate anche le raccomandazioni delle principali società mondiali in merito all'uso di Paxlovid nelle pazienti in gravidanza e in allattamento. La popolazione in gravidanza è una categoria ad alto rischio per la malattia COVID-19. Data la loro esclusione negli studi clinici, sono disponibili dati limitati sull'uso di Paxlovid nelle donne in gravidanza e in allattamento. L'evidenza indiretta dell'uso di ritonavir come parte della terapia HAART nella popolazione in gravidanza e in allattamento con HIV non ha mostrato teratogenicità significativa.
Paxlovid, investimenti insufficienti e timori per rebound ed effetti collaterali stanno riducendo l'uso di un antivirale salvavita3 gennaio 2023. Nature. COVID drug Paxlovid was hailed as a game-changer. What happened?Quando i dati della sperimentazione clinica per il farmaco antivirale Paxlovid sono emersi alla fine del 2021, i medici hanno salutato la sua sorprendente efficacia: una riduzione di quasi il 90% del rischio di COVID-19 grave. Ma più di un anno dopo, il COVID-19 rimane una delle principali cause di morte in molti paesi, e non solo nelle nazioni a basso reddito dove la droga scarseggia.
I ricercatori affermano che il lancio del farmaco è stato ostacolato dalle preoccupazioni per il "rimbalzo" (il misterioso ritorno dei sintomi o il virus rilevabile giorni dopo che una persona inizia a sentirsi meglio) e dagli effetti collaterali, nonché dalla diminuzione della preoccupazione per il rischio di COVID-19, dal prezzo elevato del farmaco e dalla necessità di assumerlo precocemente ne hanno rallentato l'assorbimento. Il sentimento contro il farmaco è persistito anche se le autorità di regolamentazione a livello globale hanno revocato le autorizzazioni per gli anticorpi monoclonali contro COVID-19, lasciando Paxlovid come uno degli unici strumenti per prevenire la morte negli individui ad alto rischio.
Paxlovid (nirmatrelvir-ritonavir) e COVID-19, farmacocinetica, efficacia, resistenza2 gennaio 2022. International Journal of Antimicrobial Agents. Nirmatrelvir and COVID-19 development, pharmacokinetics, clinical efficacy, resistance, relapses, and pharmacoeconomics.
Lo sviluppo preclinico di nirmatrelvir/ritonavir (N/R) è stato rapido e ha contribuito ad alleviare il carico sanitario di COVID-19 nel 2022. Si è dimostrato un farmaco straordinariamente efficace, diventando l'antivirale più prescritto nel mondo e generando $1,5 miliardi di vendite nel primo trimestre del 2022: ad esempio, negli Stati Uniti è prescritto a più di 160.000 pazienti a settimana a partire da maggio 2022, e in Italia a partire dal 21 giugno 2022 è stato prescritto a più di 17.000 pazienti. Gli studi clinici randomizzati sono stati condotti esclusivamente con varianti pre-Omicron, ma gli studi in vitro mostrano che l'efficacia contro tutte i sottolignaggi di Omicron è preservata, come confermato da studi osservazionali post-marketing. Nonostante ciò, le interazioni farmacocinetiche stanno impedendo il dispiegamento in pazienti fragili e con comorbidità, che rappresentano il peso residuo della pandemia. Inoltre, le resistenze emergenti dal trattamento, le ricadute precoci e la sostenibilità economica rappresentano nuvole all'orizzonte che potrebbero minare il futuro a lungo termine di N/R.
Paxlovid, efficacia e sicurezza28 dicembre 2022. J Med Virol. Efficacy and safety of nirmatrelvir/ritonavir (Paxlovid) for COVID-19 : a rapid review and meta-analysisNell'analisi sono stati inclusi 23 studi che hanno coinvolto 314.353 pazienti. I risultati della meta-analisi hanno mostrato una differenza significativa tra i gruppi Paxlovid e no-Paxlovid in termini di tasso di mortalità (odds ratio [OR] = 0,25, 95% intervallo di confidenza [CI]: da 0,14 a 0,45), tasso di ospedalizzazione (OR = 0,40, IC 95%: da 0,24 a 0,69), tempo di conversione negativo della reazione a catena della polimerasi (PCR) (differenza media [MD] = -2,46, IC 95%: da -4,31 a -0,61) e tasso di ospedalizzazione o mortalità (OR = 0,17, IC 95%: da 0,06 a 0,46). Tuttavia, non è stata osservata alcuna differenza significativa tra i due gruppi in termini di rimbalzo (OR = 0,84, IC 95%: da 0,67 a 1,04), visite al pronto soccorso (OR = 0,75, IC 95%: da 0,45 a 1,24), ricovero in terapia intensiva (OR = 0,37, IC 95%: da 0,13 a 1,01) ed eventi avversi (OR = 2,20, IC 95%: da 0,42 a 11,47).
Effetto rimbalzo dopo il trattamento con nirmatrelvir/ritonavir26 dicembre 2022. J Med Virol. Coronavirus disease 2019 rebounds following nirmatrelvir/ritonavir treatmentIn rare occasioni, alcuni pazienti sperimentano un rimbalzo virologico e sintomatico dopo la risoluzione iniziale.
Sulla base delle prove limitate, l'incidenza del rebound dei sintomi di COVID-19 dopo nirmatrelvir/ritonavir era inferiore al 2% e la maggior parte dei casi si è sviluppata 5-15 giorni dopo l'inizio del trattamento. Quasi tutti i casi segnalati presentavano sintomi lievi e la condizione clinica si è gradualmente attenuata senza ulteriori trattamenti. Nel complesso, l'esito clinico è stato favorevole e solo un piccolo numero di pazienti ha richiesto visite al pronto soccorso o ricovero in ospedale. Per quanto riguarda il rimbalzo virologico, è stato osservato SARS-CoV-2 possibilmente trasmissibile, quindi potrebbe essere necessario il reisolamento.
Nirmatrelvir più Ritonavir contro COVID-19 precoce in uno studio statunitense13 dicembre 2022. Ann Intern Med. Nirmatrelvir Plus Ritonavir for Early COVID-19 in a Large U.S. Health System : A Population-Based Cohort StudyLo studio è stato condotto durante l'ondata di Omicron (dal 1 gennaio al 17 luglio 2022) su 44.551 adulti non ospedalizzati (90,3% con ≥3 dosi di vaccino) di età pari o superiore a 50 anni con COVID-19 e nessuna controindicazione per nirmatrelvir più ritonavir. Durante il periodo di studio, a 12.541 (28,1%) pazienti è stato prescritto nirmatrelvir più ritonavir, mentre a 32.010 (71,9%) no. I pazienti a cui era stato prescritto avevano maggiori probabilità di essere più anziani, avere più comorbilità ed essere vaccinati. L'esito composito di ospedalizzazione o decesso si è verificato in 69 pazienti a cui era stato prescritto nirmatrelvir più ritonavir e in 310 a cui non era stato prescritto. I destinatari di nirmatrelvir più ritonavir avevano un minor rischio di ospedalizzazione e morte.
Antivirali nei bambini per curare Covid-195 dicembre 2022. Pharmaceuticals. Update on COVID-19 Therapy in Pediatric AgeQuattro diversi antivirali, remdesivir (RVD), la combinazione nirmatrelvir più ritonavir (Paxlovid), molnupiravir (MPV) e l'anticorpo monoclonale bebtelovimab (BEB), sono attualmente approvati o autorizzati per l'uso di emergenza per il trattamento di COVID-19 dalla maggior parte delle autorità nazionali autorità sanitarie, anche se con limitazioni in funzione della rilevanza clinica della malattia e delle caratteristiche del paziente. Lo studio della letteratura mostra che MPV non può essere utilizzato in età pediatrica per il rischio di eventi avversi sulla crescita ossea. Gli altri antivirali possono essere utilizzati, almeno nei bambini più grandi, e RDV può essere utilizzato in tutti i bambini tranne che nei neonati. Tuttavia, è urgentemente necessaria un'attenta ricerca sui dati farmacocinetici e clinici raccolti specificamente nei neonati e nei bambini per gestire in modo appropriato la malattia pediatrica.
Rebound virale dopo il trattamento con Paxlovid (Nirmatrelvir-Ritonavir) e Molnupiravir1 dicembre 2022. JAMA Netw Open. Incidence of Viral Rebound After Treatment With Nirmatrelvir-Ritonavir and MolnupiravirDi 12.629 pazienti, 11.688 (92,5%) non assumevano antivirali orali, 746 (5,9%) assumevano molnupiravir e 195 (1,5%) nirmatrelvir-ritonavir. Rispetto ai non utilizzatori, gli utilizzatori di antivirali orali erano più anziani, avevano più comorbidità e avevano tassi di vaccinazione completa inferiori. Il rimbalzo virale si è verificato in 68 non utilizzatori (0,6%), in 2 soggetti in cura con nirmatrelvir-ritonavir (1,0%) e 6 con molnupiravir (0,8%). In questo studio di coorte, il rebound virale è raro nei pazienti che assumevano molnupiravir o nirmatrelvir-ritonavir e non era associato a un aumentato rischio di mortalità.
Paxlovid associato a diminuzione del tasso di ospedalizzazione25 novembre 2022. CDC. MMWR. Paxlovid Associated with Decreased Hospitalization Rate Among Adults with COVID-19 — United States, April–September 2022Tra gli adulti statunitensi con diagnosi di COVID-19, compresi quelli con precedente infezione o vaccinazione, le persone a cui è stato prescritto Paxlovid entro 5 giorni dalla diagnosi hanno avuto un tasso di ospedalizzazione inferiore del 51% entro 30 giorni dalla diagnosi rispetto a coloro a cui non è stato prescritto Paxlovid.
Molnupiravir e Nirmatrelvir-Ritonavir associati a ridotta mortalità e risparmio sui costi5 ottobre 2022. Lancet Reg Health West Pac. Association of Molnupiravir and Nirmatrelvir-Ritonavir with preventable mortality, hospital admissions and related avoidable healthcare system cost among high-risk patients with mild to moderate COVID-19Lo studio di coorte retrospettivo ha coinvolto 54.355 pazienti con COVID-19 dal 22 febbraio al 31 marzo 2022 a Hong Kong. Di interesse era la prescrizione di Molnupiravir e Nirmatrelvir-Ritonavir e l'associazione con la mortalità per tutte le cause come risultato primario. Nella coorte ambulatoriale (N = 33.217, 61,1%), il 16,1% ha utilizzato Molnupiravir e il 13,4% Nirmatrelvir-Ritonavir, mentre nella coorte dei pazienti ricoverati (N = 21.138, 38,9%), il 3,8% Molnupiravir e l'1,3% Nirmatrelvir-Ritonavir. Molnupiravir e Nirmatrelvir-Ritonavir erano significativamente associati a un ridotto rischio di mortalità. Inoltre, nella coorte ambulatoriale, entrambe le prescrizioni antivirali erano associate a probabilità ridotte di ricoveri ospedalieri non pianificati e tra i pazienti ospedalizzati, entrambe le prescrizioni antivirali sono state associate a riduzioni significative del rischio di riammissione a 28 giorni.
Lista di controllo per le interazioni farmacologiche con Paxlovid4 ottobre 2022. JAMA. Paxlovid Drug Interaction Screening Checklist UpdatedL'FDA ha aggiornato una lista di controllo progettata per aiutare a valutare le potenziali interazioni farmacologiche e altri fattori del paziente prima di prescrivere Paxlovid (compresse di Nirmatrelvir e Ritonavir) per COVID-19. Include una guida sui farmaci che non devono essere assunti con Paxlovid o che potrebbero richiedere aggiustamenti della dose.
Efficacia di Paxlovid, una meta-analisi30 settembre 2022. Journal of Infection. Efficacy and safety of Paxlovid for COVID-19:a meta-analysisNell'analisi finale sono stati inclusi 13 studi che hanno coinvolto 186.306 pazienti. Tre studi hanno descritto il rimbalzo dei pazienti COVID-19 nel gruppo Paxlovid e nel gruppo di controllo. L'OR complessivo dell'effetto rimbalzo tra i pazienti COVID-19 nel gruppo Paxlovid rispetto al gruppo di controllo era 0,99 (IC 95%, 0,28-3,57; I2 = 59%), P = 0,99. Cinque studi hanno descritto eventi avversi nel gruppo Paxlovid e nel gruppo di controllo. L'OR complessivo degli eventi avversi tra i pazienti COVID-19 nel gruppo Paxlovid rispetto al gruppo di controllo era 1,07 (IC 95%, 0,49-2,34; I2 = 90%), P = 0,87. Non vi è alcuna differenza significativa di rimbalzo ed eventi avversi tra il gruppo Paxlovid e il gruppo di controllo. In conclusione, la ricerca mostra che Paxlovid contro COVID-19 è efficace e sicuro.
Paxlovid per prevenire e trattare COVID: la revisione Cochrane20 settembre 2022. Cochrane Reviews. Nirmatrelvir combined with ritonavir for preventing and treating COVID-19E' stato considerato uno studio con 2246 partecipanti su nirmatrelvir/ritonavir rispetto al placebo nel trattamento di COVID-19 in pazienti ambulatoriali. I partecipanti inclusi non erano stati vaccinati, non avevano una precedente infezione da SARS-CoV-2 confermata, avevano un esordio dei sintomi non superiore a cinque giorni prima dell'inizio del trattamento ed erano ad alto rischio di progressione verso malattia grave a causa di una comorbidità o di un fattore di rischio come il fumo.
Sono stati esaminati 8 studi in corso su nirmatrelvir in combinazione con ritonavir (Paxlovid). Paxlovid può portare a un minor numero di decessi e a migliorare le condizioni del paziente, valutando la necessità di ricovero o morte entro 28 giorni.
I dati sono disponibili solo per le persone non vaccinate ad aumentato rischio di progressione della malattia che ricevono un trattamento entro cinque giorni dall'esordio dei sintomi.
La nostra ricerca sarà aggiornata ogni mese.
5 agosto 2022. WHO. Nirmatrelvir-ritonavir for COVID-19. Infografica con le informazioni essenziali per la somministrazione della terapia.
5 agosto 2022. WHO. Safety and monitoring for patients receiving Nirmatrelvir-ritonavir for COVID-19
Paxlovid in pazienti immunocompromessi e ricoverati con SARS-CoV-214 luglio 2022. Lancet Infect Dis. Paxlovid in patients who are immunocompromised and hospitalised with SARS-CoV-2 infectionQuesto studio sui dati reali di pazienti cinesi con infezione da SARS-CoV-2 ha sollecitato l'implementazione del trattamento precoce di paxlovid per i pazienti ad alto rischio che sono immunocompromessi, compresi quelli che sono ricoverati in ospedale e in particolare i non vaccinati, al fine di facilitare l'eradicazione del virus.
Paxlovid, il coronavirus può eludere il farmaco?30 giugno 2022. Science. Bad news for Paxlovid? Coronavirus can find multiple ways to evade COVID-19 drugStudi recenti suggeriscono che il virus è pronto a sviluppare resistenza, un destino che colpisce molti farmaci antivirali. Due preprint pubblicati su bioRxiv il 7 giugno, ad esempio, mostrano che SARS-coV-2 coltivato in laboratorio acquisisce rapidamente la capacità di evitare l'attacco di nirmatrelvir. Due gruppi di ricerca hanno coltivato in modo indipendente il coronavirus con bassi livelli di nirmatrelvir, uccidendo alcuni, ma non tutti i virus. Tali test hanno lo scopo di simulare ciò che potrebbe accadere in una persona infetta che non assume l'intero regime del farmaco o in un paziente immunocompromesso che ha difficoltà a eliminare il virus.
Paxlovid e recrudescenza di COVID-19 dopo il trattamento20 giugno 2022. Clinical Infectious Diseases. Virologic and Immunologic Characterization of COVID-19 Recrudescence after Nirmatrelvir/Ritonavir TreatmentI ricercatori hanno valutato uno dei pazienti in cui i sintomi sono tornati dopo il completamento del trattamento e hanno scoperto che la loro ricaduta dei sintomi non era causata dallo sviluppo di resistenza al farmaco o da una ridotta immunità contro il virus. Piuttosto, la ricaduta di COVID-19 sembra essere il risultato di un'esposizione insufficiente al farmaco.
14 giugno 2022. Pfizer Reports Additional Data on PAXLOVID™Supporting Upcoming New Drug Application Submission to U.S. FDAPfizer ha condiviso i dati dello studio di fase 2/3 EPIC-SR (Evaluation of Protease Inhibition for COVID-19 in Standard-Risk Patients) che valuta l'uso di PAXLOVID (nirmatrelvir [PF-07321332] compresse e ritonavir compresse) in pazienti che sono a rischio di sviluppare COVID-19 grave.
Paxlovid e le interazioni farmaco-farmaco
14 maggio 2022. Clin Pharmacol Ther. Recommendations for the management of drug-drug interactions between the COVID-19 antiviral nirmatrelvir/ritonavir (Paxlovid®) and comedications
La revisione riassume gli effetti del ritonavir sulla disposizione del farmaco (cioè metabolizzazione di enzimi e trasportatori) e discute i fattori che determinano la probabilità di avere interazioni farmaco-farmaco (DDI) clinicamente significative. Lo studio fornisce un elenco completo di co-medicazioni che potrebbero essere utilizzate nei pazienti COVID-19 classificati in base al loro potenziale rischio di DDI con Paxlovid e discute anche le raccomandazioni per la gestione delle DDI che bilanciano il rischio di danno da DDI con un breve ciclo di ritonavir, contro il rifiuto non necessario del trattamento NMV/r.
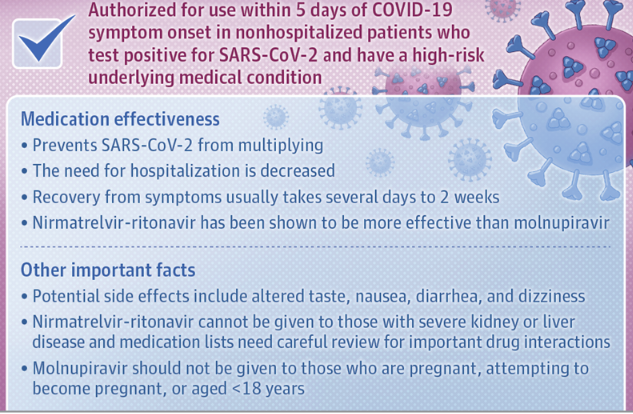
Molnupiravir e Nirmatrelvir-ritonavir riducono la capacità di SARS-CoV-2 di moltiplicarsi e diffondersi25 aprile 2022. JAMA Patient Page. Oral Antiviral Medications for COVID-19Questi 2 farmaci antivirali, nirmatrelvir potenziato con ritonavir (Paxlovid, nirmatrelvir-ritonavir) e molnupiravir (Lagevrio), sono attualmente disponibili negli Stati Uniti con autorizzazione all'uso di emergenza. I 2 farmaci sono autorizzati per il trattamento di pazienti con COVID-19 da lieve a moderato, non ricoverati in ospedale, ma sono ad alto rischio di sviluppare una malattia grave. Approvati per l'uso solo entro 5 giorni dall'insorgenza dei sintomi di COVID-19, nirmatrelvir-ritonavir e molnupiravir devono essere presi in considerazione per i pazienti con sintomi di COVID-19 che risultano positivi per SARS-CoV-2 e che sono un adulto più anziano (di età pari o superiore a 65 anni) o di età pari o superiore a 12 anni con una condizione sottostante che aumenta il rischio di gravi esiti (come cancro, malattie cardiache, diabete e obesità).
Paxlovid: AIFA, lo possono prescrivere anche i medici di medicina generale20 aprile 2022. A partire dal 21 aprile, anche i medici di famiglia possono prescrivere l'antivirale Paxlovid, indicato per il trattamento di pazienti adulti che non necessitano di ossigenoterapia supplementare e che sono ad elevato rischio di progressione a COVID-19 severa per patologie pregresse. Il trattamento deve essere iniziato il più precocemente possibile, e comunque entro 5 giorni dall’insorgenza dei sintomi. La prescrizione richiede un’anamnesi farmacologica per escludere la presenza di eventuali interazioni con farmaci assunti contemporaneamente dal paziente. Leggi il
comunicato stampa di AIFA
Paxlovid (nirmatrelvir-ritonavir) efficacia contro Covid-1916 febbraio 2022. Nejm. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19
Il medicinale contiene due principi attivi, nirmatrelvir e ritonavir, presenti in due compresse distinte: nirmatrelvir agisce riducendo la capacità del SARS-CoV-2 di replicarsi nell’organismo, mentre ritonavir (farmaco già da tempo utilizzato nel trattamento dell’infezione da HIV) non ha attività antivirale ma funziona da booster farmacologico prolungando l’azione di nirmatrelvir. In questo studio in doppio cieco, controllato con placebo, nirmatrelvir più ritonavir, se somministrati entro 5 giorni dall'esordio dei sintomi a pazienti ad alto rischio di progressione della malattia, hanno ridotto dell'87,8% il rischio di ospedalizzazione o morte correlata a Covid-19.
Paxlovid presto disponibile in Italia, AIFA definisce le regole di utilizzo28 gennaio 2022. Paxlovid (PF-07321332 e ritonavir), che nello studio si è dimostrato efficace nel ridurre dell’88% il rischio di ospedalizzazione e morte, è indicato per il trattamento di pazienti adulti con malattia lieve-moderata che non necessitano ossigenoterapia e con condizioni cliniche che rappresentino fattori di rischio per lo sviluppo di COVID-19 severo. Il trattamento con Paxlovid deve essere iniziato entro 5 giorni dall’insorgenza dei sintomi e ha una durata di 5 giorni. Le modalità per la selezione dei pazienti e per la prescrivibilità e distribuzione del farmaco saranno le stesse già stabilite per l’altro antivirale orale (molnupiravir). Leggi il
comunicato stampa di AIFA
Paxlovid: FDA autorizza uso di emergenza22 dicembre 2021. FDA Authorizes First Oral Antiviral for Treatment of COVID-19L'FDA ha rilasciato l'autorizzazione l'autorizzazione all'uso di emergenza per Paxlovid di Pfizer (compresse di nirmatrelvir e di ritonavir, confezionate insieme per uso orale) per il trattamento della malattia da coronavirus da lieve a moderata negli adulti e nei pazienti pediatrici (12 anni di età e oltre che pesano almeno 40 chilogrammi o circa 88 libbre) positivi al test SARS-CoV-2 e che sono ad alto rischio di progressione verso COVID-19 grave, incluso ricovero in ospedale o morte. Il medicinale sarà disponibile solo su prescrizione medica e deve essere iniziato il prima possibile dopo la diagnosi di COVID-19 ed entro cinque giorni dall'insorgenza dei sintomi.
Paxlovid, il parere di EMA e l'avvio della rolling review16 dicembre 2021.
Il Comitato per i medicinali per uso umano (CHMP) dell’
EMA ha formulato un parere sull'uso di Paxlovid (PF-07321332 e ritonavir) per il trattamento di COVID-19. Il medicinale, che non è ancora autorizzato nell’UE, può essere utilizzato per il trattamento di adulti con COVID-19 che non necessitano di ossigenoterapia supplementare e che sono ad alto rischio di progredire alla forma grave della malattia. Paxlovid deve essere somministrato il prima possibile dopo una diagnosi di COVID-19 ed entro 5 giorni dall’insorgenza dei sintomi. I due principi attivi del medicinale, PF-07321332 e ritonavir, disponibili sotto forma di compresse separate, devono essere assunti insieme due volte al giorno per 5 giorni. Leggi il
comunicato stampa di AIFA
14 dicembre 2021. Paxlovid antivirale di Pfizer, dati finali del trial EPIC-HR e risultati del trial di fase 2/3 EPIC-SR
- I dati finali dei 2.246 pazienti ad alto rischio arruolati nello studio EPIC-HR hanno confermato i risultati precedenti dell'analisi ad interim che mostrano che Paxlovid (PF-07321332/ritonavir) ha ridotto il rischio di ospedalizzazione o morte dell'89% (entro tre giorni dall'insorgenza dei sintomi) e 88% (entro cinque giorni dall'insorgenza dei sintomi) rispetto al placebo; nessun decesso rispetto al placebo è occorso negli adulti non ospedalizzati ad alto rischio con COVID-19.
- Analisi intermedie di un secondo studio in corso, in adulti a rischio standard (EPIC-SR) hanno mostrato una riduzione del 70% dei ricoveri ospedalieri e nessun decesso nella popolazione trattata, rispetto al placebo, nell'endpoint secondario; il nuovo endpoint primario ovvero l'auto-segnalazione dell'alleviamento prolungato di tutti i sintomi per quattro giorni consecutivi, rispetto al placebo, non è stato raggiunto. Lo studio continua.
- Una diminuzione approssimativa di 10 volte della carica virale al giorno 5, rispetto al placebo, è stata osservata sia in EPIC-HR che in EPIC-SR, indicando una forte attività contro SARS-CoV-2 e rappresentando la più forte riduzione della carica virale riportata fino ad oggi in un agente antivirale orale contro COVID-19.
Paxlovid (PF-07321332/ritonavir): EMA, avvia revisione19 novembre 2021. EMA sta conducendo una revisione dei dati attualmente disponibili sull’uso di Paxlovid (PF-07321332/ritonavir), un medicinale orale per il trattamento di COVID-19 sviluppato da Pfizer. leggi il
comunicato stampa di AIFA
Ritonavir: Paxlovid, antivirale orale di Pfizer, i risultati dell'analisi intermedia dello studio EPIC-HR di fase 2/35 novembre 2021. Pfizer’s Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk Of Hospitalization Or Death By 89% In Interim Analysis Of Phase 2/3 EPIC-HR StudyÈ stato riscontrato che Paxlovid™ (PF-07321332; ) riduce il rischio di ospedalizzazione o morte dell'89% rispetto al placebo negli adulti con COVID-19 ad alto rischio non ospedalizzati. Nella popolazione complessiva dello studio fino al giorno 28, non sono stati segnalati decessi nei pazienti che hanno ricevuto Paxlovid™ rispetto ai 10 decessi nei pazienti che hanno ricevuto placebo. Pfizer prevede di inviare i dati alla FDA degli Stati Uniti per l'autorizzazione all'uso di emergenza (EUA) il prima possibile.
Per saperne di più sulle cure anti Covid, torna all'approfondimento:




