Lagevrio (molnupiravir), un farmaco antivirale (profarmaco metabolizzato all’analogo ribonucleosidico N idrossicitidina), è stato
sospeso dall’Agenzia a seguito del parere negativo formulato dal CHMP di
EMA in data 24/02/2023 per la mancata dimostrazione di un beneficio clinico in termini di riduzione della mortalità e dei ricoveri ospedalieri. Il farmaco era stato inizialmente reso disponibile tramite autorizzazione alla distribuzione in emergenza ai sensi del’Art.5.2 del DL 219/2006 (
Decreto Ministeriale del 26 novembre 2021 e successive proroghe).
Per approfondire consulta:
Uso degli antivirali per COVID-19 di AIFA
Efficacia del trattamento con nirmatrelvir-ritonavir o molnupiravir tra i veterani statunitensi
6 giugno 2023. Ann Intern Med. Effectiveness of COVID-19 Treatment With Nirmatrelvir-Ritonavir or Molnupiravir Among U.S. Veterans: Target Trial Emulation Studies With One-Month and Six-Month OutcomesL'obiettivo dello studio è esaminare l'incidenza di qualsiasi ricovero o mortalità per tutte le cause a 30 giorni e da 31 a 180 giorni.
Nirmatrelvir-ritonavir si è dimostrato efficace nel ridurre l'ospedalizzazione a 30 giorni e la mortalità; Molnupiravir è stato associato a un beneficio per la mortalità a 30 giorni ma non per l'ospedalizzazione. Con entrambi gli antivirali sono state osservate ulteriori riduzioni di mortalità nel follow up da 31 a 180 giorni.
Molnupiravir può accelerare la guarigione, ma non riduce significativamente mortalità e ricovero
28 maggio 2023. Int J Antimicrob Agents. Efficacy and safety of molnupiravir treatment for COVID-19: a systematic review and meta-analysis of randomized controlled trials.
Sono stati inclusi 9 RCT, per un totale di 31.573 pazienti COVID-19, di cui 15.846 hanno ricevuto molnupiravir. I risultati della meta-analisi hanno mostrato che il gruppo molnupiravir aveva una proporzione maggiore in termini di miglioramento clinico e negatività alla RT‒PCR. Tuttavia, nessuna differenza significativa è stata osservata tra i due gruppi in termini di mortalità, ospedalizzazione, eventi avversi ed eventi avversi gravi.
Da ciò gli autori concludono che Molnupiravir can accelerate the rehabilitation of COVID-19 patients, but it does not significantly reduce mortality and hospitalization.
Molnupavir, efficacia e sicurezza: una revisione e meta-analisi
15 maggio 2023. J Antimicrob Chemother. Efficacy and safety of molnupiravir for the treatment of SARS-CoV-2 infection: a systematic review and meta-analysisIn una popolazione prevalentemente immunizzata di pazienti ambulatoriali con COVID-19, molnupiravir non ha alcun effetto sulla mortalità, probabilmente nessuno su "ospedalizzazione o morte" e gli effetti sulla risoluzione dei sintomi sono incerti. Molnupiravir è risultato sicuro durante il periodo di studio nei pazienti ambulatoriali, sebbene un potenziale aumento della mortalità ospedaliera richieda un attento monitoraggio nella ricerca clinica in corso. L'analisi non supporta l'uso di routine di molnupiravir per il trattamento di COVID-19 in soggetti immunocompetenti.
Efficacia, tollerabilità di Molnupiravir, Remdesivir e Nirmatrelvir/ritonavir: dati del mondo reale nei primi dieci mesi di utilizzo
28 aprile 2023. Viruses. Effectiveness, Tolerability and Prescribing Choice of Antiviral Molecules Molnupiravir, Remdesivir and Nirmatrelvir/r: A Real-World Comparison in the First Ten Months of UseNel 2022 sono stati introdotti tre farmaci antivirali, molnupiravir, remdesivir e nirmatrelvir/ritonavir, per il trattamento di COVID-19 da lieve a moderato nei pazienti ad alto rischio, in cui la vaccinazione potrebbe non essere sufficiente per la prevenzione della malattia grave. Lo scopo dello studio è valutare la loro efficacia e tollerabilità in un contesto di vita reale. È stato avviato uno studio osservazionale monocentrico, con il coinvolgimento di 1118 pazienti, con dati di follow-up completi, trattati tra il 5 gennaio e il 3 ottobre 2022 presso un ospedale di Latina, Centro Italia. Un'analisi univariata e un'analisi multivariata sono state eseguite rispettivamente sui dati clinici e demografici e sull'esito composito, la persistenza dei sintomi a 30 giorni e il tempo alla negativizzazione. I tre antivirali hanno mostrato un'efficacia simile nel contenere la progressione dell'infezione a COVID-19 grave e una buona tollerabilità in assenza di gravi effetti avversi. La persistenza dei sintomi dopo 30 giorni era più comune nelle donne rispetto ai maschi e meno comune nei pazienti trattati con molnupiravir e nirmatrelvir/ritonavir. La disponibilità di diverse molecole antivirali è uno strumento forte e, se correttamente prescritte, possono avere un ruolo significativo nel modificare la storia naturale dell'infezione per le persone fragili, in cui la vaccinazione potrebbe non essere sufficiente per la prevenzione del COVID-19 grave.
10 marzo 2023. AIFA sospende Lagevrio® (molnupiravir)La
Commissione Tecnico Scientifica di AIFA ha deciso di sospendere l’utilizzo del medicinale antivirale Lagevrio® (molnupiravir) a seguito del parere negativo formulato dal CHMP di EMA, in data 24/02/2023, per la mancata dimostrazione di beneficio clinico in termini di riduzione di mortalità e ricoveri ospedalieri.
Efficacia e sicurezza di molnupiravir per pazienti non e ospedalizzati con COVID-1927 febbraio 2023. J Med Virol. Clinical efficacy and safety of molnupiravir for nonhospitalized and hospitalized patients with COVID-19: A systematic review and meta-analysis of randomized control trialsL'obiettivo dello studio è indagare i benefici clinici del molnupiravir per i pazienti non e ospedalizzati con COVID-19. Tuttavia, molnupiravir potrebbe non migliorare gli esiti clinici dei pazienti ospedalizzati. I risultati, invece supportano l'uso per il trattamento di pazienti non ospedalizzati con COVID-19.
Molnupiravir per COVID-19 da lieve a moderato in pazienti adulti durante Omicron15 febbraio 2023. Antibiotics (Basel).
Real-World Clinical Outcomes of Molnupiravir for the Treatment of Mild to Moderate COVID-19 in Adult Patients during the Dominance of the Omicron Variant: A Meta-Analysis.
Per essere inclusi nella meta-analisi, gli studi dovevano confrontare direttamente l'efficacia clinica di molnupiravir nel trattamento di pazienti adulti COVID-19 con quella del placebo. Gli studi sono stati inclusi sulla base dei seguenti risultati: mortalità per tutte le cause, esito composito della progressione della malattia, tasso di ospedalizzazione e carica virale. La meta-analisi ha incluso 6 studi che hanno indicato che il rischio di mortalità è stato ridotto del 34% e il rischio di esito composito della progressione della malattia del 37% tra i pazienti che hanno ricevuto molnupiravir. Molnupiravir è stato associato a una riduzione più rapida della carica virale rispetto al placebo. Non vi è stato alcun beneficio clinico nel ridurre la mortalità per tutte le cause nei pazienti COVID-19 da lievi a moderati con un'elevata copertura vaccinale COVID-19.
Molnupiravir per il trattamento di COVID-19 in soggetti immunocompromessi17 gennaio 2023. Infection. Molnupiravir for the treatment of COVID-19 in immunocompromised participants: efficacy, safety, and virology results from the phase 3 randomized, placebo-controlled MOVe-OUT trial.Nella fase 3 del trial MOVE-OUT, gli adulti a rischio non ospedalizzati, con COVID-19 da lieve a moderato, sono stati randomizzati a ricevere molnupiravir 800 mg o placebo due volte al giorno per 5 giorni. I partecipanti immunocompromessi sono stati identificati sulla base di farmaci precedenti/concomitanti e/o anamnesi. Sebbene la popolazione in studio fosse numericamente poco rappresentativa, questi dati suggeriscono che il trattamento con molnupiravir per COVID-19 da lieve a moderato negli adulti immunocompromessi non ospedalizzati è efficace e sicuro e riduce rapidamente infezioni da SARS-CoV-2.
Profilo di sicurezza di molnupiravir nel trattamento di COVID-1922 dicembre 2022. J Clin Med. Safety Profile of Molnupiravir in the Treatment of COVID-19: A Descriptive Study Based on FAERS DataI dati sulla sicurezza di molnupiravir sono stati acquisiti dal sistema di segnalazione degli eventi avversi (FAERS) dell'FDA. E' stata eseguita un'analisi descrittiva delle caratteristiche demografiche dei pazienti che hanno manifestato almeno una reazione avversa al farmaco (ADR) correlata a molnupiravir e quindi sono state valutate quelle più frequentemente riportate. Al 31 marzo 2022, sono state presentate all'FDA 612 segnalazioni di ADR correlate a molnupiravir, 301 (49,18%) relative a donne e 281 (45,92%) a uomini. La maggior parte delle segnalazioni (524; 85,62%) sono state presentate da operatori sanitari e 345 (56,37%) riguardavano esiti gravi. Le ADR riportate più comunemente sono state diarrea (57; 4,51%), eruzione cutanea (36; 2,85), nausea (29; 2,30%) e polmonite da COVID-19 (22; 1,74%).
Anche se non sono emersi evidenti problemi di sicurezza, si è verificato un tasso inaspettatamente elevato di reazioni avverse gravi insieme ad alcuni casi di potenziali nuove reazioni avverse.
Molnupiravir + cure standard come trattamento precoce per adulti con COVID-19 a rischio di esiti avversi22 dicembre 2022. Lancet. Molnupiravir plus usual care versus usual care alone as early treatment for adults with COVID-19 at increased risk of adverse outcomes (PANORAMIC): an open-label, platform-adaptive randomised controlled trialPANORAMIC è uno studio controllato, randomizzato, multicentrico, in aperto, multigruppo, prospettico, svolto nel Regno Unito. I partecipanti eleggibili avevano un'età pari o superiore a 50 anni o di età pari o superiore a 18 anni con comorbidità rilevanti e COVID-19 confermato da 5 giorni o meno. I partecipanti sono stati assegnati in modo casuale (1:1) a ricevere 800 mg di molnupiravir due volte al giorno per 5 giorni più cure abituali o solo cure abituali. Per la randomizzazione è stato utilizzato un sistema sicuro basato sul web (Spinnaker), stratificato per età (<50 anni vs ≥50 anni) e stato di vaccinazione (sì vs no). Gli esiti di COVID-19 sono stati monitorati tramite un diario quotidiano online autocompilato per 28 giorni dopo la randomizzazione. Tra l'8 dicembre 2021 e il 27 aprile 2022, 26.411 partecipanti sono stati assegnati in modo casuale, 12.821 a molnupiravir più cure standard, 12.962 solo alle cure abituali e 628 ad altri gruppi di trattamento (che saranno riportati separatamente). L'età media della popolazione era di 56,6 anni (DS 12,6) e 24.290 (94%) su 25.708 partecipanti avevano ricevuto almeno tre dosi di un vaccino SARS-CoV-2.
Molnupiravir non ha ridotto i ricoveri o i decessi in una popolazione adulta vaccinata con COVID-19 a maggior rischio di esito avverso, sia in generale che in qualsiasi sottogruppo di pazienti. Tuttavia, molnupiravir è stato associato a un tempo di guarigione ridotto in generale e per i principali sintomi individuali, una riduzione della ricerca di assistenza sanitaria e una ridotta carica virale. I trial con molnupiravir sono stati precedentemente condotti in partecipanti in gran parte non vaccinati prima dell'emergere della variante Omicron. Questo studio fornisce una stima dell'efficacia di molnupiravir in una popolazione vaccinata quando Omicron era dominante.
Per approfondire leggi anche
Covid-19: Molnupiravir does not cut hospital admissions or deaths in vaccinated people at high risk, trial finds. BMJ. 2022 Dec 23;379:o3055.
Antivirali nei bambini per curare Covid-195 dicembre 2022. Pharmaceuticals. Update on COVID-19 Therapy in Pediatric AgeQuattro diversi antivirali, remdesivir (RVD), la combinazione nirmatrelvir più ritonavir (Paxlovid), molnupiravir (MPV) e l'anticorpo monoclonale bebtelovimab (BEB), sono attualmente approvati o autorizzati per l'uso di emergenza per il trattamento di COVID-19 dalla maggior parte delle autorità nazionali autorità sanitarie, anche se con limitazioni in funzione della rilevanza clinica della malattia e delle caratteristiche del paziente. Lo studio della letteratura mostra che MPV non può essere utilizzato in età pediatrica per il rischio di eventi avversi sulla crescita ossea. Gli altri antivirali possono essere utilizzati, almeno nei bambini più grandi, e RDV può essere utilizzato in tutti i bambini tranne che nei neonati. Tuttavia, è urgentemente necessaria un'attenta ricerca sui dati farmacocinetici e clinici raccolti specificamente nei neonati e nei bambini per gestire in modo appropriato la malattia pediatrica.
Rebound virale dopo il trattamento con Paxlovid (Nirmatrelvir-Ritonavir) e Molnupiravir1 dicembre 2022. JAMA Netw Open. Incidence of Viral Rebound After Treatment With Nirmatrelvir-Ritonavir and MolnupiravirDi 12.629 pazienti, 11.688 (92,5%) non assumevano antivirali orali, 746 (5,9%) assumevano molnupiravir e 195 (1,5%) nirmatrelvir-ritonavir. Rispetto ai non utilizzatori, gli utilizzatori di antivirali orali erano più anziani, avevano più comorbidità e avevano tassi di vaccinazione completa inferiori. Il rimbalzo virale si è verificato in 68 non utilizzatori (0,6%), in 2 soggetti in cura con nirmatrelvir-ritonavir (1,0%) e 6 con molnupiravir (0,8%). In questo studio di coorte, il rebound virale è raro nei pazienti che assumevano molnupiravir o nirmatrelvir-ritonavir e non era associato a un aumentato rischio di mortalità.
Molnupiravir e Nirmatrelvir-Ritonavir associati a ridotta mortalità e risparmio sui costi5 ottobre 2022. Lancet Reg Health West Pac. Association of Molnupiravir and Nirmatrelvir-Ritonavir with preventable mortality, hospital admissions and related avoidable healthcare system cost among high-risk patients with mild to moderate COVID-19Lo studio di coorte retrospettivo ha coinvolto 54.355 pazienti con COVID-19 dal 22 febbraio al 31 marzo 2022 a Hong Kong. Di interesse era la prescrizione di Molnupiravir e Nirmatrelvir-Ritonavir e l'associazione con la mortalità per tutte le cause come risultato primario. Nella coorte ambulatoriale (N = 33.217, 61,1%), il 16,1% ha utilizzato Molnupiravir e il 13,4% Nirmatrelvir-Ritonavir, mentre nella coorte dei pazienti ricoverati (N = 21.138, 38,9%), il 3,8% Molnupiravir e l'1,3% Nirmatrelvir-Ritonavir. Molnupiravir e Nirmatrelvir-Ritonavir erano significativamente associati a un ridotto rischio di mortalità. Inoltre, nella coorte ambulatoriale, entrambe le prescrizioni antivirali erano associate a probabilità ridotte di ricoveri ospedalieri non pianificati e tra i pazienti ospedalizzati, entrambe le prescrizioni antivirali sono state associate a riduzioni significative del rischio di riammissione a 28 giorni.
Molnupavir, efficacia contro Covid ma necessari studi su vaccinati e nuove varianti10 settembre 2022. Ir J Med Sci. Efficacy and safety of Molnupiravir in COVID-19 patients: a systematic reviewL'evidenza degli studi clinici ha mostrato che Molnupiravir ha causato una riduzione significativa del rischio di ospedalizzazione o morte in pazienti con COVID-19 lieve ad alto rischio. Molnupiravir è risultato anche ben tollerato e sicuro senza eventi avversi importanti sull'uso a breve termine. Per l'uso confermativo di questo farmaco nella malattia da COVID-19 da lieve a moderata, sono necessari ulteriori studi nei pazienti vaccinati con COVID-19 e contro le varianti emergenti.
5 agosto 2022. WHO.
Administration of Molnupiravir for COVID-19. Infografica con le informazioni essenziali per la somministrazione della terapia.
5 agosto 2022. WHO. Safety and monitoring for patients receiving Molnupiravir for COVID-19
Molnupiravir nei pazienti con infezione da SARS-CoV-2: idati dal mondo reale20 luglio 2022. J Med Virol. Safety and efficacy of molnupiravir in SARS-CoV-2 infected patients: a real-life experience.Dati real life mostrano che Monlupiravir ha confermato la sua efficacia e sicurezza in una coorte che includeva un'alta percentuale di anziani con un elevato carico di comorbilità.
Eventi avversi associati a Molnupiravir27 giugno 2022. Br J Clin Pharmacol. Rapid Review and Meta-Analysis of Adverse Events Associated with Molnupiravir in Patients with COVID-19Quattro studi che hanno coinvolto 2241 pazienti hanno soddisfatto i criteri di inclusione. Non è stata osservata alcuna differenza significativa tra molnupiravir a 200, 400 e 800 mg rispetto al placebo per qualsiasi evento avverso, per eventi avversi che hanno portato alla morte e per interruzione del trattamento a causa di eventi avversi. Questa meta-analisi ha mostrato che l'uso di tre dosi di molnupiravir (200, 400 e 800 mg) è sicuro per i pazienti con COVID-19.
13 giugno 2022. Ministero della Salute. Proroga autorizzazione alla temporanea distribuzione del farmaco antivirale molnupiravir
26 aprile 2022. Molnupiravir, alcune lettere esprimono i dubbi di esperti sul BMJ
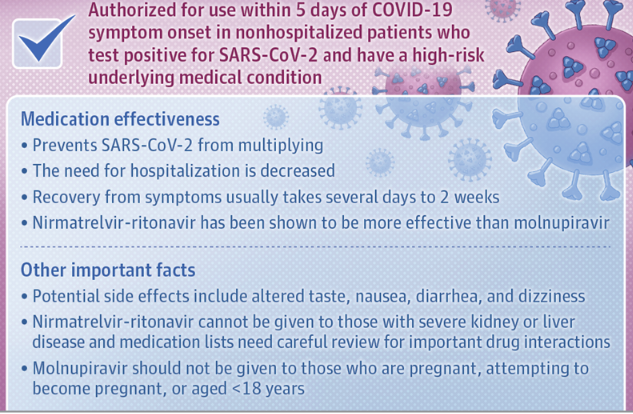
Molnupiravir e Nirmatrelvir-ritonavir riducono la capacità di SARS-CoV-2 di moltiplicarsi e diffondersi.25 aprile 2022. JAMA Patient Page. Oral Antiviral Medications for COVID-19Questi 2 farmaci antivirali, nirmatrelvir potenziato con ritonavir (Paxlovid, nirmatrelvir-ritonavir) e molnupiravir (Lagevrio), sono attualmente disponibili negli Stati Uniti con autorizzazione all'uso di emergenza. I 2 farmaci sono autorizzati per il trattamento di pazienti con COVID-19 da lieve a moderato, non ricoverati in ospedale, ma sono ad alto rischio di sviluppare una malattia grave. Approvati per l'uso solo entro 5 giorni dall'insorgenza dei sintomi di COVID-19, nirmatrelvir-ritonavir e molnupiravir devono essere presi in considerazione per i pazienti con sintomi di COVID-19 che risultano positivi per SARS-CoV-2 e che sono un adulto più anziano (di età pari o superiore a 65 anni) o di età pari o superiore a 12 anni con una condizione sottostante che aumenta il rischio di gravi esiti (come cancro, malattie cardiache, diabete e obesità).
Molnupavir: autorizzazione prematura?3 marzo 2022. BMJ. Molnupiravir's authorisation was prematureLe prove per introdurre molnupiravir nella pratica di routine sono fragili. L'autorizzazione normativa prematura e le raccomandazioni delle linee guida sulla base di risultati di studi troncati e non replicati e senza una piena considerazione della significatività clinica, non statistica, e dell'efficacia in termini di costi sono ben al di sotto della saggia gestione delle limitate risorse sanitarie necessarie durante un'emergenza sanitaria globale.
Molnupavir: WHO, nuova raccomandazione condizionale all'uso3 marzo 2022. Nell'aggiornamento di
Therapeutics and COVID-19: living guideline, WHO raccomanda l'
uso di Molnupiravir per i pazienti con COVID-19 non grave, per quelli a più alto rischio di ricovero (escluse donne in gravidanza o allattamento e bambini).
Molnupiravir, fluvoxamina e Paxlovid contro Covid: una metanalisi4 febbraio 2022. Ann Med. Efficacy and safety of three new oral antiviral treatment (molnupiravir, fluvoxamineand Paxlovid) for COVID-19: a meta-analysisQuesto studio ha dimostrato che tre nuovi antivirali orali (molnupiravir, fluvoxamina e Paxlovid) sono efficaci nel ridurre i tassi di mortalità e ospedalizzazione nei pazienti con COVID-19. Inoltre, i tre farmaci non hanno aumentato il verificarsi di eventi avversi, mostrando così una buona sicurezza generale. Sebbene siano ancora in fase di studio, i dati disponibili suggeriscono che porteranno nuove speranze per la guarigione da COVID-19.
Antivirali orali: AIFA pubblica il primo report sul monitoraggio21 gennaio 2022. L’AIFA pubblica i risultati del monitoraggio relativo agli antivirali orali per il trattamento del COVID-19 attualmente disponibili (Veklury, Remdesivir - Gilead, Lagevrio, Molnupiravir - Merck). Leggi il
comunicato stampa di AIFA e scarica il report
Molnupiravir: OK di AIFA per trattamento dei pazienti non ospedalizzati ad alto rischio di malattia grave30 dicembre 2021. La Commissione Tecnico Scientifica di AIFA ha autorizzato due antivirali - molnupiravir e remdesivir - per il trattamento di pazienti non ospedalizzati per COVID-19 con malattia lieve-moderata di recente insorgenza e con condizioni cliniche concomitanti che rappresentino specifici fattori di rischio per lo sviluppo di COVID-19 grave. Leggi il
comunicato stampa di AIFA
Molnupiravir: ok dell'FDA in alcuni gruppi di persone23 dicembre 2021. FDA Authorizes Additional Oral Antiviral for Treatment of COVID-19 in Certain AdultsL'FDA ha rilasciato l'autorizzazione all'uso di emergenza per Molnupiravir di Merck per il trattamento della malattia da coronavirus da lieve a moderata (COVID-19) negli adulti. Molnupiravir è disponibile solo su prescrizione medica e deve essere iniziato il prima possibile dopo la diagnosi di COVID-19 ed entro cinque giorni dall'insorgenza dei sintomi.
Molnupiravir per il trattamento precoce e ambulatoriale di Covid-1916 dicembre 2021. NEJM. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized PatientsÈ sempre più necessario un trattamento ambulatoriale orale per Covid-19. In questo studio in doppio cieco, randomizzato e controllato di fase 3, molnupiravir, un antivirale, è stato studiato in pazienti non vaccinati con meno di 5 giorni di malattia Covid-19. Al giorno 29, il ricovero per progressione di Covid-19 è stato inferiore con molnupiravir (6,8%) rispetto al placebo (9,7%).
Per saperne di più, leggi l'editoriale
Molnupiravir — A Step toward Orally Bioavailable Therapies for Covid-19
Lagevrio (molnupiravir): Riesame EMA dei dati sull'efficacia per il trattamento di COVID-1915 dicembre 2021.
Le
raccomandazioni formulate da EMA nel novembre 2021, nel contesto di un riesame, si basavano su una valutazione dei dati intermedi dello studio disponibili in quel momento. Nelle persone maggiormente a rischio di sviluppare la forma grave della malattia, stando ai risultati aggiornati riferiti a 1408 soggetti, Lagevrio ha ridotto il rischio di ricovero in ospedale o di decesso dal 9,7% nel gruppo che ha ricevuto placebo al 6,8% nel gruppo trattato con Lagevrio. EMA fornirà un aggiornamento sull'esito della domanda di autorizzazione all'immissione in commercio attualmente in fase di valutazione. Leggi il
comunicato stampa di AIFA
EMA, parere sull'uso di Lagevrio (molnupiravir) e richiesta 22 e 24 novembre 2021. Il medicinale, che al momento non è autorizzato in UE, può essere utilizzato per il trattamento di adulti con COVID-19 che non necessitano di ossigenoterapia supplementare e che sono ad alto rischio di sviluppare la forma grave della malattia. Lagevrio deve essere somministrato il prima possibile dopo una diagnosi di COVID-19 ed entro 5 giorni dall’insorgenza dei sintomi. L’EMA ha formulato il parere per supportare le autorità nazionali che potrebbero decidere di approvarne l’uso in situazioni di emergenza, alla luce dell’aumento dei tassi di infezione e decessi a causa di COVID-19 in tutta l’UE. Nel frattempo, è in corso una rolling review più completa per la domanda di autorizzazione all'immissione in commercio da parte di Merck Sharp & Dohme in collaborazione con Ridgeback Biotherapeutics. Leggi il
comunicato stampa di AIFA sul parere di EMA e il
comunicato stampa di AIFA sulla richiesta a EMA di immissione in commercio
Molnupiravir: EMA, occorre revisione a sostegno di possibili decisioni nazionali sull'uso precoce8 novembre 2021. Molnupiravir è un antivirale orale che riduce la capacità del SARS CoV 2 (il virus che provoca COVID 19) di moltiplicarsi nell’organismo.
L'Agenzia europea per i medicinali ha convenuto che occorrono ulteriori raccomandazioni sui trattamenti contro COVID-19 alla luce dell’aumento dei tassi di infezione e dei decessi dovuti alla malattia in tutta l'UE. Mentre è in corso la più esauriente rolling review su Molnupiravir in vista di un'eventuale domanda di autorizzazione all'immissione in commercio, il Comitato per i medicinali per uso umano dell’EMA fornirà nel più breve tempo possibile raccomandazioni a livello dell'UE per supportare le autorità nazionali nelle decisioni in merito a un possibile uso precoce del medicinale, ad esempio in situazioni di emergenza. Leggi il
comunicato stampa di AIFA
Molnupiravir: Lagevrio, antivirale orale contro COVID-19 approvato dall'MHRA in UK4 novembre 2021.
First oral antiviral for COVID-19, Lagevrio (molnupiravir), approved by MHRA Medicines and Healthcare L'antivirale Lagevrio (molnupiravir) è sicuro ed efficace nel ridurre il rischio di ospedalizzazione e morte nelle persone con COVID-19 da lieve a moderato che sono a maggior rischio di sviluppare malattie gravi, ha annunciato l'Agenzia britannica di regolamentazione dei medicinali e dei prodotti sanitari (MHRA).
30 ottobre 2021.
Diabetes Metab Syndr.
Molnupiravir in COVID-19: A systematic review of literatureMessaggi chiave:
- Gli studi di fase 1 sull'uomo hanno mostrato che molnupiravir è sicuro e tollerabile.
- Gli studi di fase 2/3 hanno mostrato l'efficacia di molnupiravir nel COVID-19 lieve.
- Tuttavia, molnupiravir non ha funzionato nel COVID-19 tardivo da moderato a grave.
- In India diversi studi di fase 3 su molnupiravir sono in corso sia contro COVID-19 lieve che moderato.
Molnupiravir: EMA avvia la rolling review25 ottobre 2021. Il Comitato per i medicinali per uso umano (CHMP) dell’EMA ha avviato la rolling review dell’antivirale orale molnupiravir (noto anche come MK 4482 o Lagevrio), sviluppato da Merck Sharp & Dohme in collaborazione con Ridgeback Biotherapeutics per il trattamento di COVID-19 negli adulti. Leggi il
comunicato stampa di AIFA
Molnupiravir, nuovo farmaco contro Covid-191 ottobre 2021.All'analisi intermedia dello studio di fase 3, Molnupiravir ha ridotto il rischio di ospedalizzazione o morte di circa il 50% rispetto al placebo per i pazienti con COVID-19 da lieve a moderato. Il 7,3% dei pazienti che hanno ricevuto il farmaco è stato ricoverato in ospedale fino al giorno 29, rispetto al 14,1% dei pazienti trattati con placebo, che sono stati ricoverati o sono deceduti.
La Merck prevede di richiedere l'autorizzazione all'uso di emergenza negli Stati Uniti il prima possibile e di presentare domanda alle agenzie di regolamentazione in tutto il mondo.
Se autorizzato, Molnupiravir potrebbe essere il primo farmaco antivirale orale per COVID-19. Leggi il
comunicato stampa della farmaceutica Merck
Per saperne di più sulle cure anti COVID-19, torna all'approfondimento:


